Основные положения атомно-молекулярного учения о строении вещества
 |
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания вдруг оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза …: все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения». Ричард Фейнман (1918-1988),
американский физик-теоретик |
п.1. Атомы и молекулы
 |
Атомы состоят из ядра и электронов. Основная масса атома – 99,9% - сосредоточена в ядре, в котором находятся положительно заряженные протоны и незаряженные нейтроны. Отрицательно заряженные электроны образуют «электронное облако» вокруг ядра. Масса протона в 1836 раз больше массы электрона, а нейтрона – в 1839 раз больше. |
Размеры атомов находятся в диапазоне от \(10^{-10}\ \text{м}\) до \(4\cdot 10^{-10}\ \text{м}\). Наименьший размер имеет атом водорода, который состоит из одного протона в ядре и одного электрона на орбите.
В целом, в любом атоме положительный заряд протонов компенсируется отрицательным зарядом электронов, и суммарный заряд равен 0.
Атом может потерять один или несколько электронов, и тогда общий заряд станет положительным. Такой атом называют положительным ионом.
Атом может также присоединить к себе один или несколько электронов. В этом случае, общий заряд будет отрицательным, и атом становится отрицательным ионом.
Изучение атомов различных химических элементов позволило выявить определенные закономерности, которые были сведены в специальную таблицу. Идею такой таблицы предложил в 1869 г. русский химик Д.И. Менделеев, поэтому она была названа его именем: «периодическая таблица Д.И. Менделеева».
Молекулы образуются двумя и больше атомами, связанными между собой за счет перекрытия электронных облаков. Такую связь в химии называют ковалентной.
| Модели молекул | ||
 |
 |
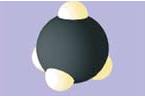 |
| Вода \(\mathrm{H_2O}\) | Сероводород \(\mathrm{H_2S}\) | Метан \(\mathrm{CH_4}\) |
 |
 |
|
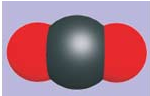
| Углекислый газ \(\mathrm{CO_2}\) | Аммиак \(\mathrm{NH_3}\) | |
В физике к молекулам также причисляют одноатомные вещества, например, одноатомные газы (гелий, неон, аргон и др.).
 Фрагмент молекулы ДНК (модель) |
Некоторые молекулы образованы очень большим количеством атомов. Если в структуре такой молекулы встречаются повторяющиеся фрагменты, её называют макромолекулой. Например, молекула ДНК, в которой хранится генетическая информация о живом организме в виде последовательностей фрагментов-нуклеотидов. В одной молекуле ДНК насчитывается несколько миллиардов атомов! |
п.2. Простые и сложные вещества
На сегодняшний день нам известно 118 химических элементов, из них в природе можно найти 92 элемента, остальные – созданы искусственно в лабораториях.
Атомы этих элементов могут образовывать огромное множество разнообразных молекул.
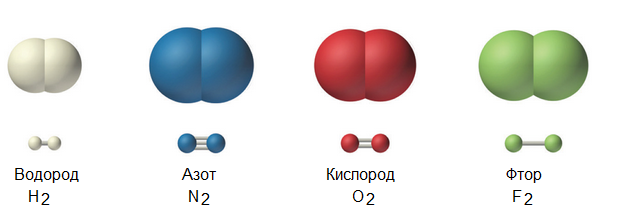
Примеры простых веществ
Множество газов состоят из молекул, образованных двумя одинаковыми атомами, т.е. эти газы являются простыми двухатомными веществами.
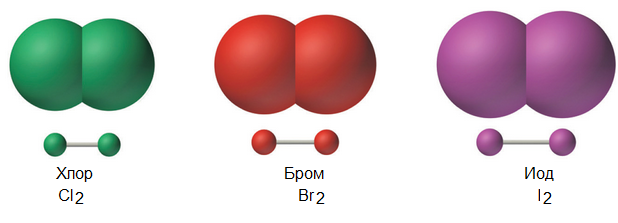
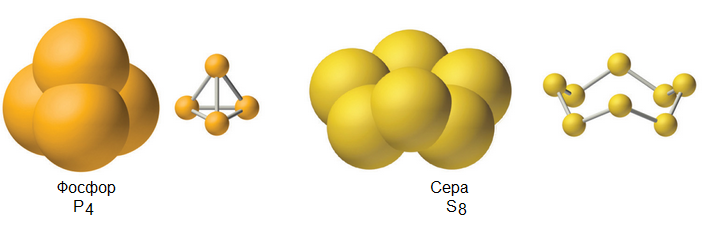
Твердые простые вещества могут образовывать сложные многоатомные молекулы.
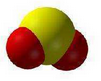
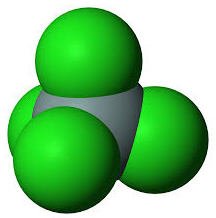
Примеры сложных веществ
 |
 |
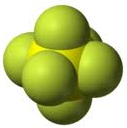 |
| Сернистый газ, \(\mathrm{CO_2}\) | Хлорид кремния, \(\mathrm{SiCl_4}\) | Фторид серы, \(\mathrm{SF_6}\) |
п.3. Непрерывное движение частиц вещества
Температура – это физическая величина, которая характеризует интенсивность теплового движения атомов или молекул тела.
Опыты, подтверждающие тепловое движение атомов и молекул
Броуновское движение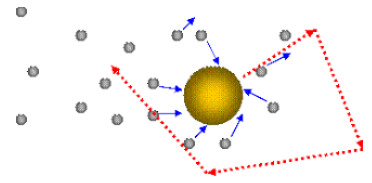 |
Атомы и молекулы слишком малы, чтобы их можно было рассмотреть в обычном оптическом микроскопе. Но в нём можно наблюдать движение более крупных частиц. Р. Броун в 1827 году, рассматривая в микроскоп взвешенные в воде споры пыльцы одного из растений, обнаружил, что они непрерывно и хаотически движутся. В школьной лаборатории можно повторить опыт Броуна. Вывод: движение броуновской частицы происходит из-за непрерывных беспорядочных ударов молекул среды (жидкости или газа). |
Диффузия |
Приготовим насыщенный раствор медного купороса. Аккуратно дольем сверху чистой воды. Между раствором и водой видна четкая граница. Спустя сутки граница будет уже размытой (фото посредине). Через неделю граница полностью исчезнет (фото справа). Вывод: в результате непрерывного движения молекул воды и медного купороса происходит диффузия - взаимное проникновение этих веществ друг в друга. |
Диффузия наблюдается во всех агрегатных состояниях: в газах, жидкостях и твердых телах.
Быстрее всего диффузия протекает в газах, медленней всего – в твердых телах.
Скорость диффузии зависит от температуры: чем выше температура контактирующих тел, тем быстрее протекает диффузия.
п.4. Притяжение и отталкивание частиц вещества
На расстояниях, сравнимых с размерами самих молекул и атомов, проявляется взаимное притяжение, а при дальнейшем сближении – отталкивание.
Явление смачивания, подтверждающее притяжение молекул вещества
Притяжение молекул твердого тела и жидкости можно наблюдать при смачивании – когда пролитая жидкость растекается по твердой поверхности. В этом случае притяжение между молекулами в самой жидкости слабее, чем притяжение между молекулами жидкости и молекулами твердого тела.
Если же притяжение между молекулами в самой жидкости сильнее, то происходит несмачивание – капля не растекается и остается шарообразной.
 Вода растекается по полу, происходит смачивание |
 Капли ртути не растекаются по полу, наблюдается несмачивание |
Опыт с ластиком, подтверждающий отталкивание молекул вещества
 |
Если взять обычный ластик и попытаться его сжать так, чтобы заметно изменить толщину, это окажется непростой задачей. Сопротивление ластика сжатию показывает, что молекулы вещества, из которого он изготовлен, отталкиваются при сближении. Поэтому ластик трудно сжимается и легко восстанавливает первоначальную форму. |
п.5. Основные положения молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) рассматривает строение вещества с точки зрения следующих положений:
- вещество состоит из мельчайших частиц – молекул и атомов, расположенных в пространстве на некоторых расстояниях друг от друга;
- частицы вещества непрерывно беспорядочно движутся;
- молекулы и атомы взаимодействуют друг с другом силами притяжения или отталкивания, которые зависят от расстояний между этими частицами.
На основе МКТ были развиты многочисленные направления современной науки (например: сопромат, физическая кинетика, статическая механика) и техники (например: строительство, металлургия, химическая промышленность).
п.6. Задачи
Задача 1. Какие опыты подтверждают, что все тела состоят из мельчайших частиц?
Все тела – твердые, жидкие и газообразные – расширяются при нагревании и сжимаются при охлаждении.
1. Опыт с нагреванием твердого тела
Для опыта понадобится: 1) металлический шарик; 2) кольцо, через которое этот шарик проходит, что называется «впритык»; 3) штатив; 4) спиртовка.
 В обычном состоянии шарик проходит сквозь кольцо. |
 Нагреем шарик и попробуем снова опустить его через кольцо. Шарик застревает. |
 Дадим шарику остыть. Он опять проходит сквозь кольцо. |
2. Опыт с нагреванием жидкости.
Для опыта понадобится: 1) стеклянная колба; 2) пробка с вставленной узкой трубкой; 3) водяная ванна, чтобы при нагреве колба не лопнула; 4) штатив; 5) спиртовка.
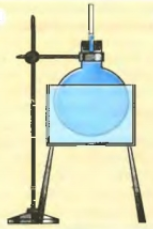 Наполним колбу подкрашенной водой доверху, закупорим пробкой и аккуратно дольем так, чтобы вода в трубке была вровень с пробкой. |
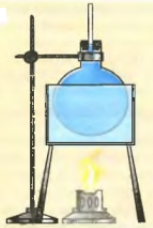 Начнем нагревать колбу. Уровень воды в трубке немного снизится, т.к. колба, нагреваясь, расширяется. |
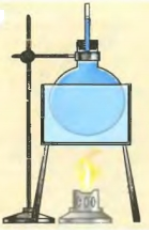 Продолжаем нагревать колбу. Сама колба больше не нагревается, теперь нагревается вода, и ее расширение заметно – уровень в трубке повышается. |
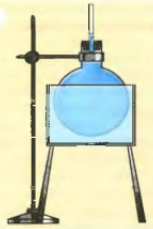 После охлаждения уровень воды становится прежним. |
3. Опыт с нагреванием газа
Для опыта понадобится: 1) стеклянная колба; 2) пробка с вставленной узкой трубкой; 3) сосуд с водой.
 |
Поместим колбу предварительно в холодильник на некоторое время. Достанем колбу из холодильника, закупорим пробкой, опустим трубку в сосуд с водой. Хорошо обхватим колбу, чтобы нагревать ее ладонями. Через некоторое время из трубки начнут появляться пузырьки – нагретый воздух выходит из колбы. |
Вывод: газы, жидкости и твердые тела меняют свой объем: расширяются при нагревании и сжимаются при охлаждении. Это можно объяснить, если предположить, что все тела состоят из мельчайших частиц, между которыми есть промежутки. При нагревании эти промежутки увеличиваются, а при охлаждении уменьшаются.
Мы не видим эти частицы только потому, что наш глаз не способен различать настолько мелкие объекты.
Задача 2. Диффузия играет важную роль, как в природе, так и в технике. Приведите соответствующие примеры.
| Поддержание смешанного состава атмосферы у поверхности Земли | Питание и дыхание растений | Поиск пищи в животном мире |
 |
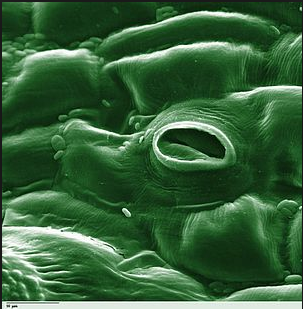 |
 |
| Нижний слой атмосферы – тропосфера – состоит из смеси газов: азота, кислорода, углекислого газа и паров воды. При отсутствии диффузии произошло бы расслоение под действием силы тяжести: внизу оказался бы слой тяжёлого углекислого газа, над ним – кислород, выше – азот и инертные газы. | Под микроскопом лист представляет собой слой клеток, плотно прилегающих друг к другу, это эпидермис. Часть клеток образуют устьица, с помощью которых происходит обмен веществами с окружающей средой. Механизмом этого обмена является диффузия. | Диффузия в воде помогает акулам «учуять» запах крови на расстоянии нескольких километров. |
| Диффузионная сварка | Нанесение гальванических покрытий | Производство сахара из свеклы |
 |
 |
 |
| Сварка за счёт взаимной диффузии на атомарном расстоянии для свариваемых поверхностей деталей. Производится под воздействием давления и нагрева свариваемых деталей в защитной среде. | Нанесение на металлическое изделие тонкой поверхностной пленки из другого металла. Под воздействием электрического тока металл, который послужит покрытием, распадается на ионы и переносится токопроводящим раствором на поверхность обрабатываемого изделия, оседая тонким слоем на его поверхности и образуя за счет диффузии смешанный слой с основным металлом. | Сахар находится внутри клеток сахарной свеклы. Свеклу измельчают в стружку и помещают в горячую воду. За счет диффузии сахар переходит из стружки в воду. Полученный раствор очищают и выпаривают. Затем с помощью центрифуг окончательно разделяют воду и кристаллический сахар. |
Задача 3. Смесь кислорода и водорода называется «гремучим газом». Даже от небольшой искры гремучий газ взрывается с образованием молекул воды. Сколько нужно молекул кислорода и водорода, чтобы образовался 1 миллион молекул воды?
Уравнение реакции $$ \mathrm{2H_2+O_2\rightarrow 2H_2O} $$
Из уравнения следует, что количество молекул воды равно количеству молекул водорода.
А молекул кислорода нужно в 2 раза меньше.
Значит, нужно 1 миллион молекул водорода и 0,5 миллиона молекул кислорода.
Ответ: 1 миллион молекул водорода и 0,5 миллиона молекул кислорода.
Задача 4. Если на блюдце с водой поставить перевернутый горячий стакан, то через некоторое время уровень воды в стакане будет выше, чем в блюдце. Объясните это явление.
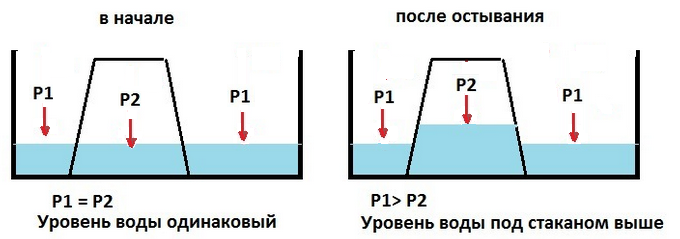
Обозначим атмосферное давление \(P_1\), давление воздуха под стаканом \(P_2\).
В начале опыта воздух в стакане горячий, атмосферное давление и давление под стаканом равны, \(P_1=P_2\). Уровень воды везде одинаковый.
При остывании давление воздуха уменьшается (молекулы движутся менее интенсивно), атмосферное давление остается неизменным, \(P_1\gt P_2\). Вода заполняет часть объема под стаканом, уровень воды под стаканом повышается до тех пор, пока сумма давления воздуха в уменьшенном объеме и давления столба поднявшейся воды не станет равна атмосферному давлению: \(P_2+P_{\text{воды}}=P_1\).


